Från en läsare inspirerad av mitt helgpyssel som tog fram sin egen grävspade och hittade intressant information beträffande GlycoImaging-projektet.Vänligt överlät inskickaren till undertecknad att läsa igenom och grunna på vad detta är och har för bäring beträffande HoloMonitor och PHI. 😎
Publication Date:April 20, 2021
Och nu har jag läst igenom denna 11-sidiga forskningsrapport och tror mig ha en aning vad det handlar om.
Ni andra phi,are får gärna gå igenom studien och ge era egna kommentarer och slutsatser.
Använd detta inläggs kommentarsfält eller mejla så lägger jag ut om det är ok. Ok?
Studien är alltså utförd av forskare kopplade till GlycoImaging.Zahra El-Schich och Anette Gjörloff-Wingren bland dem.
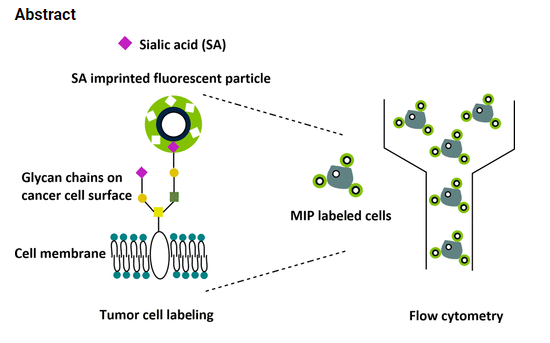
I abstractet får vi vägledande info. Öppna pdf-en för bättre överskådlighet.
ABSTRACT:
Glycoproteins are abundant on the cell surface of
mammals, providing structural support, modulating cell membrane
properties, and acting as signaling agents.
Variation of glycosylation
patterns has been found to indicate various disease states, including
cell malignancy.
Sialic acid (SA) is present as a terminating group on
cell-surface glycans, and its overexpression has been linked to several
types of cancer.
Detection of SA on the cell surface is therefore
critical for detection of cancer in its early stages.
In this work, a
fluorescent molecularly imprinted polymer layer targeting SA was
synthesized on the surface of silica-coated polystyrene (PS)
particles.
Compared to previous works, a PS core supplies a lighter,
lower-density support for improved suspension stability and
scattering properties.
Moreover, their smaller size provides a higher
surface-area-to-volume ratio for binding.
The incorporation of a
fluorescent monomer in the MIP shell allowed for simple and rapid determination of binding specificity in polar media due to a
deprotonation−reprotonation interaction mechanism between the fluorescent monomer and SA, which led to spectral changes.
Upon titration of the MIP particles with SA in suspension, an increase in fluorescence emission of the particles was observed, with
the MIP particles binding SA more selectively compared to the nonimprinted polymer (NIP) control particles.
In cell staining
experiments performed by flow cytometry, the binding behavior of the MIP particles compared favorably with that of SA-binding
lectins.
NIPs prepared with a “dummy” template served as a better negative control in cell binding assays due to the favorable inward
orientation of template-binding functional groups in the polymer shell, which reduced nonspecific binding.
The results show that
fluorescent MIPs targeting SA are a promising tool for in vitro fluorescence staining of cancerous cells and for future diagnosis of
cancer at early stages.
KEYWORDS: Sialic acid, fluorescence, molecularly imprinted polymers, cancer cells, flow cytometry
Sen hoppar jag direkt ner till avslutningen där det blir mer tydligt vad det handlar om.
Conclusions
We synthesized fluorescent MIP shells targeting SA on a silica�coated PS core, allowing for the first-time direct determination
of SA in solution by fluorescence titrations in DMF, a polar
solvent.
The interaction mode introduced here stresses the
potential that deprotonation−reprotonation mechanisms can
play for traditional hydrogen bonding receptor units such as
ureas in polar protic solvents when appropriately substituted,
well complementing a recent approach on sensory MIPs for
phospholipids.
Moreover, the MIP particles can be a useful
tool for in vitro staining of cancer cells since the binding
behavior compared favorably to that of SA-binding lectins,
which is advantageous due to the comparable long-term
stability of synthetic MIPs under ambient conditions.
It was
found that conventional NIPs prepared in the absence of
template displayed high unspecific binding to cells due to
random distribution of functional monomers on the particle
surface.
In contrast, NIPs prepared with a “dummy” template
allowed appropriate orientation of the functional monomers
within the polymer shell, leading to reduced nonspecific
binding to cells.
Further studies are being carried out with
various cell lines to validate the performance of the MIPs in
cell staining applications..
Min kommentar
I min tolkning har forskarna vässat MIP,sarna genom att addera en ny funktion som gör dessa MIP,sar ännu effektivare än tidigare visat.
Först en rekapitulation. MIP,sarna utvecklades initialt tillsammans med och syfte att kunna användas av PHI´s teknik,HoloMonitorsystemet, för slutanvändarna.Dvs onkologer,läkare och andra cancerbehandlare.
MEN.Det forskarna nu har gjort är att de även inkluderat möjligheten att använda den fluorescenserande tekniken.
MIP,sarna i studien applicerades med ett ämne som kan detekteras via ett Fluo-mikroskop.
Värdet av det gör MIP,sarnas funktion än bättre.Dessa MIP,sar kommer nu ha möjlighet att bättre navigera sig fram till target area.
Effektiviteten för dessa MIP,sar förbättrades alltså ytterligare (eller om det ev kan handla om 1 till funktion utöver tidigare bevisat).
För GlycoImaging som teknik har nu innehållet, och dess värde, höjts avsevärt.
Ägaren till tekniken kan med detta justera upp bokfört värde med xxx? procent.
Den observante noterar naturligtvis arbetet PHI tillsammans med amerikanska NIH håller på att slutföra.
Kombon Holo/Fluo.
Med dessa upptäckter forskarna gjort kommer kombon bli oemotståndlig* (mitt subjektiva ordval*) för aktörer som ovan uppräknat.
Att GlycoImaging-tekniken har potential att bli en värdig utmanare till GRAIL-tekniken framstår som en lågoddsare.Det i rätt ägares händer,en bjässe med muskler.
Detta är mina slutsatser. Ni phi,are får gärna kommentera dessa och/eller komma med andra åsikter.
Till mejlaren/grävaren lyfter jag min imaginära hatt och säger tack för upptäckten. This is BIG.
Den första
kommentaren från en forskarkollega har kommit och han håller med mig.
Mvh the99
https://patentscope.wipo.int/search/en/detail.jsf?docId=WO2020201147&_cid=P11-KO32LD-78377-3
SvaraRaderaTack för info.
SvaraRaderaMvh the99